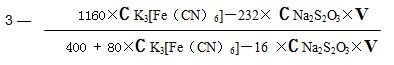Méthode d'essai d'indice d'oxygène d'oxyde de tungstène bleu

1.Principe
Le test de l'indice d'oxygène de l'oxyde de tungstène bleu est basé sur sa solubilité dans une solution d'hydroxyde de potassium et de ferricyanure de potassium. On obtient l'acide tungstique de potassium (K2WO4). Une solution surdosée de ferricyanure de potassium réagit avec l’iode de potassium en solution acide, l’iode est libéré. Titrer avec une solution standard de thiosulfate de sodium pour calculer l’indice oxygène de l’oxyde de tungstène bleu.
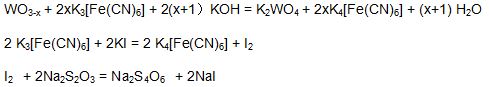
2.Agent
(1) Hydroxyde de potassium, qualité analytique, 10 g / 100 ml.
(2) Acide chlorhydrique, qualité analytique, 1 + 1.
(3) Iodure de potassium, qualité analytique, 10 g / 100 ml.
(4) Sulfate de zinc, qualité analytique, 10 g / 100 ml.
(5) Amidon, qualité analytique, 1 g / 100 ml.
(6) Titrant de bichromate de potassium: pesez 2,4515 g, séchez-le à une température de 140 ~ 150 et dissolvez-le dans de l'eau, placez-le dans une fiole jaugée de 1000 ml, diluez à l'échelle, mélangez-les. La concentration est de 0,05 mol / L.
(7) Solution étalon de thiosulfate de sodium: peser 12,5 g de solution étalon de thiosulfate de sodium et dissoudre dans de l’eau, ajouter 0,1 g de soude, mélanger, filtrer dans une bouteille brune de 1000 ml, diluer avec de l’eau et laisser reposer pendant une semaine pour la standardisation. La concentration est de 0,05 mol / L.
Normalisation: peser 20 ml, solution standard de bichrome à 0,05 mol / L dans une fiole triangulaire de 250 ml, ajouter 20 ml de HCl, 20 ml de solution d'iode et de potassium, mélanger, mettre au repos pendant 5 min, incliner avec une solution de thiosulfate de sodium jusqu'à ce qu'il devienne brun clair, ajouter 1 ml de solution d'amidon, Continuez à incliner jusqu'à la disparition de la couleur bleue de la solution. Le volume de la solution de thiosulfate de sodium est V0ml, réaction chimique:
3 Na 2 S 2 O 3 + K 2 Cr 2 O 7 + 6HCl = 2 Cr (OH) SO 4 + 4 NaCl + 3S + 2H 2 O + KCl + Na 2 SO 4
Calculer la solution molaire de thiosulfate de sodium:
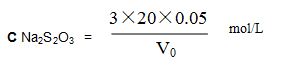
(8 solution Solution standard de ferricyanure de potassium: pesez 66 grammes de solution analytique de ferricyanure de potassium dans un ballon de 250 ml, ajoutez de l'eau et dissolvez, versez dans une bouteille de 1000 ml, ajoutez de l'eau et diluez, mélangez, la concentration est de 0.02mol / L.
Normalisation: peser 5 ml de solution standard de ferricyanure de potassium dans un flacon triangulaire de 250 ml, ajouter 20 ml de HCl, 20 ml de solution de potassium iodée, mélanger, mettre au repos pendant 5 minutes, incliner avec une solution de thiosulfate de sodium jusqu'à ce qu'il devienne brun clair, ajouter 1 ml de solution d'amidon, maintenir l'inclinaison jusqu'à bleu la couleur de la solution disparaît. Le volume de la solution de thiosulfate de sodium est égal à V1ml. Calculez la concentration molaire de la solution standard de ferricyanure de potassium:
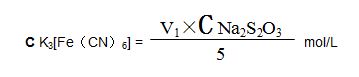
Méthode 2.Analyze
Peser 0,2 gramme d’échantillon dans une bouteille triangulaire de 250 ml, ajouter 5 ml de solution standard de ferricyanure de potassium, 15 ml de solution d’hydroxyde de potassium, souffler et nettoyer le bord de la bouteille, faire chauffer et dissoudre pendant 15 minutes à 70 ° C jusqu’à dissolution complète de l’échantillon, refroidir à température ambiante. Ajoutez 20 ml d’acide chlorhydrique, 20 ml de solution d’iodure de potassium, mélangez-les et laissez-les encore pendant 5 min, inclinez-les avec une solution de thiosulfate de sodium à 0,05 mol / L jusqu’à ce qu’ils virent au brun clair, ajoutez 1 ml de solution d’amidon, maintenez-les inclinés jusqu’à ce que la solution disparaisse. Le volume de la solution de thiosulfate de sodium est de Vml.
2.1 Calcul de l'indice d'oxygène: